Se remettre d'un AVC avec les cellules souches MSC
L'AVC est une interruption brutale du flux sanguin constant vers le cerveau qui entraîne une perte de la fonction neurologique, il en existe 3 types : une artère bloquée (ischémique accident vasculaire cérébral) ou fuite ou éclatement d'un vaisseau sanguin (hémorragique accident vasculaire cérébral) et accident ischémique transitoire (AIT également connu sous le nom de mini AVC). Différents facteurs peuvent entraîner un accident vasculaire cérébral : l'hypertension artérielle, l'hypercholestérolémie, le diabète et les fumeurs. Les cellules souches mésenchymateuses (CSM) sont non seulement sûres, mais aussi l'un des seuls traitements pouvant améliorer l'état du patient après un AVC. Une étude montre qu'avec le modèle d'occlusion de l'artère cérébrale, l'efficacité des cellules souches mésenchymateuses activées par l'interféron-γ (aMSCγ) en tant que traitement aigu de l'AVC.
Les AVC hémorragiques représentent 13% de tous les AVC, mais sont responsables de 40% de décès liés à un AVC, tandis que les AVC ischémiques représentent 87%. De plus, jusqu'à 50% des patients victimes d'AVC dépendent encore des soins 1 an après l'ictus initial et signalent des troubles de la mémoire, de la parole et des activités quotidiennes. L'AVC hémorragique est causé par la rupture d'un vaisseau sanguin et l'extravasation subséquente de sang dans le crâne, et peut être divisé en sous-types en fonction de l'emplacement du saignement, y compris l'hémorragie sous-arachnoïdienne (HSA), l'hémorragie intracérébrale (ICH) et l'hémorragie intraventriculaire (IVH ). Les saignements dans le cerveau entraînent une privation d'oxygène et de glucose dans les tissus périlésionnels et déclenchent une réponse inflammatoire secondaire qui contribue à l'expansion des lésions, nuit aux résultats pour les patients et pour laquelle il existe une pénurie de thérapeutiques.
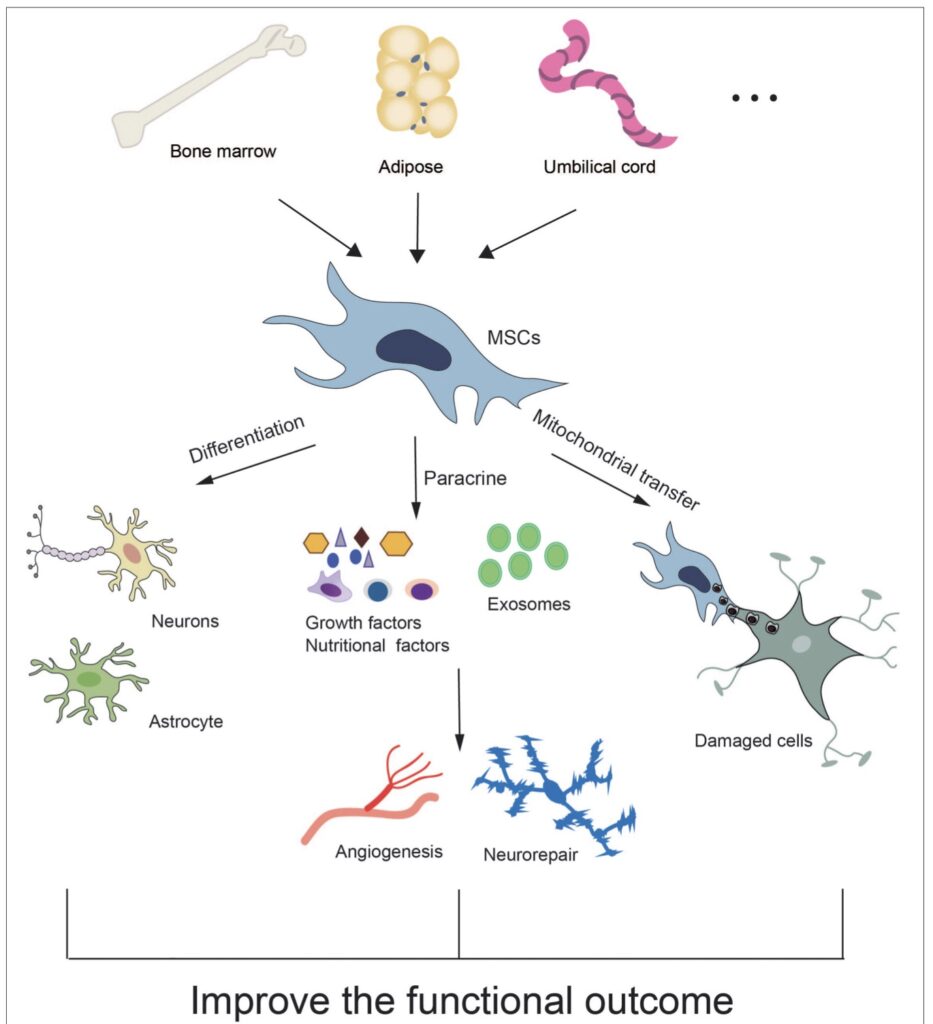
Des études ont utilisé des CSM d'origine humaine pour traiter l'hémorragie intracrânienne. Environ 60% de MSC provenaient de la moelle osseuse (BM-MSC), car il s'agit d'une source viable des deux humains, alors que des cellules ombilicales/placentaires/amniotiques ont été utilisées dans environ un quart des études, et le reste dérivé de cellules adipeuses. tissus (AT-MSC). Ces dernières sources provenaient toutes de tissus humains. Les MSC étaient généralement caractérisées par l'expression de marqueurs de surface cellulaire évalués par cytométrie en flux ou par des méthodes immunohistochimiques. Les MSC étaient positifs pour CD29, CD44, CD73, CD90 et CD105 entre autres, et négatifs pour les marqueurs de lignée hématopoïétique, CD14, CD34 et CD45, le marqueur de cellules souches CD133 et le marqueur de cellules endothéliales, CD144,30,31,32,33,34,35,36,37,38,39,40,41 qui est conforme aux directives.
Cellules souches du sang de cordon ombilical
Les cellules souches du sang de cordon ombilical humain (UC-BSC) sont dérivées des tissus placentaires, après la naissance. Ils sont constitués de cellules souches hématopoïétiques et de CSM. Ces cellules offrent un certain nombre d'avantages clés, tels qu'une source abondante de cellules, un faible âge du donneur et de faibles risques pour les bébés et les mères lors de la récolte, ce qui minimise les préoccupations éthiques. Ces cellules peuvent se différencier en cellules progénitrices neurales et fournir des effets neuroprotecteurs dans l'ischémie cérébrale via la sécrétion de facteurs neurotrophiques et l'amélioration du remodelage vasculaire après un AVC.62,63]. Les UC-BSC ont des effets protecteurs contre les lésions ischémiques, entraînant la récupération de l'expression du facteur neurotrophique dérivé du cerveau [64]. De plus, les UC-BSC peuvent inhiber la réponse immunitaire et diminuer la taille de la lésion cérébrale ischémique [65].
Voies d'administration des cellules souches
Administration intraveineuse
L'administration intraveineuse contourne le besoin d'accéder directement au SNC, permettant ainsi un caractère moins invasif [60,68]. Les NSC injectés par voie intraveineuse peuvent traverser la BHE et se localiser dans les zones de lésions ischémiques. L'administration intraveineuse de NSC, BM-MSC, AD-MSC ou UC-BSC a montré une neuroprotection dans l'AVC ischémique [39,48,60,64,65,69].
Livraison intra-artérielle
L'administration intra-artérielle (IA) utilise le cathétérisme pour guider les cellules souches dans l'artère carotide ou le cercle de Willis, contournant ainsi l'absorption initiale par les organes systémiques. L'administration d'IA s'est avérée avantageuse pour l'administration de CSM sur le site de la blessure [78–80]. Cette méthode de livraison permet le pontage des poumons et évite le piégeage pulmonaire [72]. Bien que cette méthode délivre un grand nombre de cellules aux lésions cérébrales, elle comporte également un risque de micro-embolie et d'ischémie cérébrale en raison de l'agrégation et de l'agglutination des cellules artérielles, entraînant une réduction du flux sanguin cérébral.81–83].Livraison intraventriculaire
Livraison intraventriculaire
L'administration intraventriculaire permet une administration directe dans le liquide céphalo-rachidien (LCR) ou le tissu interstitiel, permettant ainsi la dispersion vers de multiples sites du cerveau et du SNC à travers le LCR. Malgré le caractère invasif de cette technique, les complications peuvent être réduites avec une formation et une technique appropriées
Intrapéritonéale
L'administration intrapéritonéale (IP) de CSM humaines (CSMh) a conduit à l'agrégation rapide des cellules dans la cavité péritonéale, et seule une petite quantité de cellules a migré ailleurs.89]. Par rapport à l'injection IV de hMSC, l'administration IP a entraîné une accumulation plus faible dans les tissus périphériques, tels que les poumons et le foie. Cependant, les cellules stromales mésenchymateuses dérivées du cordon ombilical (UC-MSC) délivrées par IP ont montré une mauvaise localisation dans le cortex frontal ischémique.90], suggérant une pénétration cérébrale limitée.
Intraparenchymateux
L'administration intraparenchymateuse localisée permet à un volume cellulaire plus élevé d'atteindre les lésions cérébrales cibles.91], évitant ainsi les effets de déviation et améliorant le rapport coût-efficacité. Il a été démontré que la transplantation intracrânienne de AD-MSC humains favorise la réparation neuronale dans les lésions d'ischémie-reperfusion cérébrale [54]. L'injection intracrânienne de MSC a été utilisée pour les lésions cérébrales hypoxiques-ischémiques néonatales [92]. L'injection sous-durale d'iPSC sur le tissu cérébral infarci peut réduire la taille de la zone d'infarctus et améliorer la fonction motrice après un AVC ischémique [93].
Livraison intranasale
L'administration intranasale est une voie d'administration de médicaments ou de cellules non invasive et relativement efficace par rapport à la transplantation intracrânienne invasive. Bien qu'il ait été reconnu comme une méthode d'administration de petits agents (par exemple, petites molécules, protéines, virus, bactéries et nanoparticules), son utilité pour l'administration cellulaire n'a été découverte qu'au cours de la dernière décennie.98]. Les cellules délivrées par voie intranasale se rassemblent sous la muqueuse nasale, près des os cornets, et voyagent à travers la plaque criblée [99]. Cette méthode de livraison est non invasive, rapide et offre un pontage BBB [100]. Les cellules ont montré un meilleur ciblage et moins d'accumulation dans les organes périphériques, par rapport au dosage systémique [101]. De plus, l'administration intranasale permet des dosages répétés [102–105], ce qui la rend plus pratique que d'autres méthodes.


Commentaire (1)
des choses intéressantes, la mère de Lindas a eu un accident vasculaire cérébral, ce serait bien d'essayer de la soigner, mais cette situation covid ne rend pas les voyages très faciles